Dr. med. Dipl. Psych. Elisabeth Petrasch-Parwez
Neurodegeneration und Aggregate bei der Huntington-Krankheit
Seit mehr als zwei Jahrzehnten beschäftigen wir uns mit der Morphologie neurodegenerativer Erkrankungen wie Huntington (HK), Parkinson, Alzheimer und spinozerebellären Ataxien. Diese Erkrankungen sind durch unterschiedlich ausgeprägte Neurodegenerationen und der Ansammlung fehlgefalteter Proteine (Aggregate) charakterisiert. Nach breiter Erfahrung mit transgenen Tiermodellen fokussieren wir uns jetzt auf Postmortem- Untersuchungen am menschlichen Huntington-Gehirn. Für die Studien konnten Gehirne von Patienten rekrutiert werden, die klinisch gut charakterisiert sind (Neurologie Josefs-Hospital Bochum, Prof. Carsten Saft) und deren Diagnose molekulargenetisch gesichert ist.
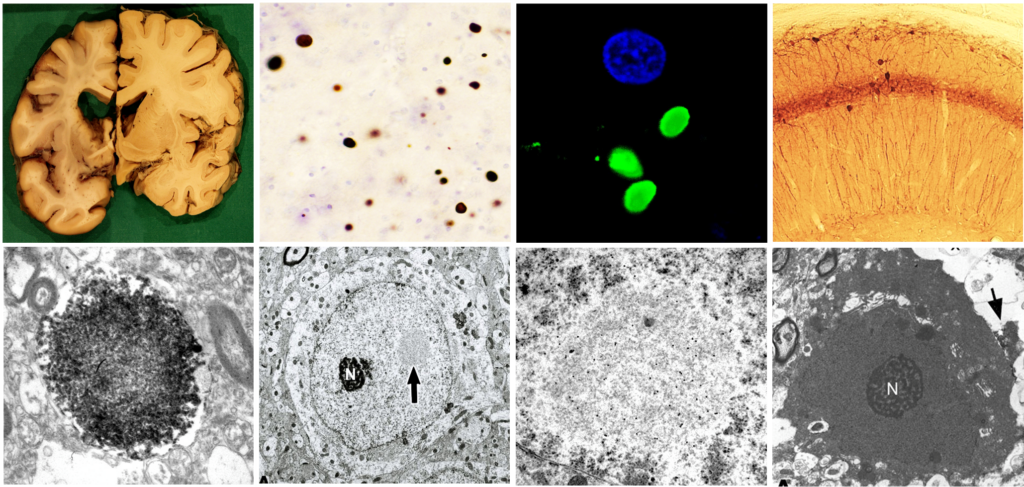
Mutiertes Huntingtin (mHTT) lässt sich in Form von unlöslichen Aggregaten in allen betroffenen Gehirnen nachweisen. In welchen Regionen Aggregate bevorzugt liegen und welche Toxizität sie auf Neurone und Gliazellen haben könnten, untersuchen wir derzeit mit den Doktoranden Paul Günther Scheunemann und Juan Azad. Die Lokalisation der Aggregate ist besonders wichtig, weil neue gentherapeutische Ansätze darauf ausgerichtet sind, die Expression des mHTT herabzusetzen oder an der Bildung zu hindern. Aggregatreiche Regionen werden mikroskopisch untersucht, um ihre subzelluläre Lokalisation in Nerven- und Gliazellen zu analysieren. Ein besonderer Schwerpunkt und völlig neu ist hier die Kolokalisation mit verschiedenen Formen des Neurofilaments, die eine enge Assoziation zum mHTT aufweisen (Scheunemann et al., unveröffentlicht). Diese Kolokalisation ist besonders interessant, weil Neurofilament L im Liquor als Biomarker zur Beurteilung der Schwere und des Verlaufs der Krankheit genutzt wird. Unsere elektronenmikroskopischen Analysen zeigen darüberhinaus, dass Aggregate mit zunehmender Größe eine differenzierte Binnenstruktur entwickeln (Petrasch-Parwez et al., 2022). Welche Bedeutung die Interaktion von mHTT und Neurofilament für die degenerierenden Nervenzellen hat und welche Proteine bei der Aggregatsubstruktur eine Rolle spielen, muss durch noch geklärt werden.
In wieweit die Stationen des visuellen Systems bei der HK betroffen sind, wird von Juan Azad näher untersucht. Nach unseren Pilotstudien zeigen die visuellen Cortices die stärksten Einbußen. Ob krankheitsbedingte visuelle Defizite ihr morphologisches Korrelat in speziellen visuellen Cortices haben könnten, steht im Vordergrund der Untersuchungen.
Die HK ist durch eine pathologisch verlängerte CAG-Wiederholung im HTT-Gen verursacht, die einer gewebespezifischen somatischen Instabilität unterliegt, was darauf hindeutet, dass unterschiedliche CAG-Längen in Hirnregionen und Organen die Klinik, den Verlauf der Erkrankung und auch die Neurodegeneration sowie Aggregatbildung mit beeinflussen könnten. Durch die Rekrutierung von Huntington-Gehirnen mit auch ganz unterschiedlichen CAG-Längen konnten wir aus vielen Regionen die somatische Expansion in Zusammenarbeit mit Frau PD Dr. L. Arning (Humangenetik, RUB) untersuchen. In einer ersten Veröffentlichung gemeinsam mit der Arbeitsgruppe um Prof. Wheeler vom Massachusetts General Hospital der Harvard Medical School (USA) konnten wir zeigen, dass die CAG-Expansionen in vielen Cortexregionen besonders hoch und darüberhinaus abhängig von der CAG-Wiederholung sind (Pinto, Arning et al., 2020). Aufbauend auf den Befunden haben wir unsere Studien um weitere Patienten und Hirnregionen erweitert Ob die regionale Lokalisation von Aggregaten mit der somatischen CAG Expansion korreliert wird derzeit an denselben Gehirnen untersucht.

Wissenschaftliche Mitarbeiterin
Ruhr-Universität Bochum
Abteilung für Neuroanatomie und Molekulare Hirnforschung
- +49 (0)234 32 25008
Aktuelle Kooperationen
- Ruhr Universität Bochum, St. Josef-Hospital, Neurologie, Huntington-Zentrum NRW (Prof. Dr. Carsten Saft, Sarah von Hein)
- Ruhr Universität Bochum, Humangenetik (Dr. Larissa Arning, Prof. Dr. Huu Phuc Nguyen)
- Ruhr-Universität Bochum, Molekulare Zellbiologie am Institut für Biochemie und Pathobiochemie (Prof. Dr. Konstanze F. Winklhofer, Dr. Verian Bader)
- Lund University, Lund, Sweden, Translational Neuroendocrine Research Unit, Department of Experimental Medical Science, Prof. Asa Petersén MD
2017 – heute Lehraufträge im Institut für Anatomie und Supervision von Doktoranden, Aufbau und Betreuung einer Brain Bank für die Huntington Krankheit
2017 – Akademische Oberrätin a. D.
1994 – Akademische Oberrätin an der Abteilung für Neuroanatomie und Molekularer Hirnforschung (Leitung 1997-2014 Prof R. Dermietzel; ab 2015 Prof. E. Förster)
1989 – Akademische Rätin am Institut für Anatomie der Medizinischen Fakultät der Ruhr-Universität Bochum (Custodenfunktion: Betreuung der Histologie des Instituts für Anatomie)
1986– Promotion Dr. med. an der Medizinischen Fakultät der Ruhr Universität Bochum bei Prof. Dr. med. K.H. Andres; Thema: Structural components of the olfactory tubercle in mammals including man
1985-88 – Wissenschaftliche Mitarbeiterin an der Ruhr-Universität Bochum bei Prof. Dr. med. K.H. Andres (Abteilung für Neuroanatomie)
1985 – Medizinisches Staatsexamen an der Gesamthochschule Essen und Approbation
1984/85 – Praktisches Jahr in den Augusta-Kranken-Anstalten Bochum und im Massachusetts General Hospital der Harvard Medical School in Boston, USA
1981-84 – Wissenschaftliche Mitarbeiterin bei Prof. K.H. Andres, Abteilung für Neuroanatomie an der Ruhr Universität Bochum der Medizinische Fakultät
1980-81 – Wissenschaftliche Hilfskraft an der Ruhr Universität Bochum bei Prof. Dr. J. Delius in der Arbeitseinheit Tierpsychologie der Fakultät für Psychologie
1979 – Diplom im Fach Psychologie mit Ausbildung in Gesprächstherapie an der Ruhr Universität Bochum.
- Anatomische Gesellschaft
- Neurowissenschaftliche Gesellschaft
- European Huntington´s Disease Network
- Deutsche Huntington-Hilfe
- Transmissionselektronenmikroskopie (Gewebe, Zellkultur, Zellsuspensionen)
- Immunhistochemie für Licht- und Elektronenmikroskopie
- Konfokale Immunfluoreszenzmikroskopie
Publikationen
Publikationen
Ausgewählte Publikationen
Petrasch-Parwez E, Habbes H-W, Löbbecke-Schumacher M, Saft, C, von Hein SM. Neuropathology in Huntington´s Disease – a balancing act between aggregates and neurodegeneration. Intech open 2022 In Book: From Pathophysiology to Treatment in Huntington´s Disease
Petrasch-Parwez E, Schöbel A, Benali A, Moinfar Z, Förster E, Brüne M, Juckel G. Lateralization of increased density of Iba1-immunopositive microglial cells in the anterior midcingulate cortex of schizophrenia and bipolar disorder. Eur Arch Psychiatry Clin Neurosci 270(7), 819-28 (2021)
Pinto RM, Arning L, Giordano JV, Razghandi P, Marissa A. Andrew, Gillis T, Correia K, Debora-M. D-M, Parwez CR, von Hein SM, Nguyen HP, Förster E, Beller E, Jayadaev S, Keene CDf, Thomas D. Bird TD, Diane Lucente D, Vonsattel J-P, Orr H, Saft C, Petrasch-Parwez E, Wheeler VC. Pattern of CAG repeat instability in the central nervous system and periphery in Huntington’s disease and in spinocerebellar ataxia type 1. Hum Mol Genet. 2020 Aug 29;29(15):2551-2567.
Van Well EM, Bader V, Patra M, Sánchez-Vicente A, Meschede J, Furthmann N, Schnack C, Blusch A, Longworth J, Petrasch-Parwez E, Mori K, Arzberger T, Trümbach D, Angersbach L, Showkat C, Sehr DA, Berlemann LA, Goldmann P, Clement AM, Behl C, Woerner AC, Saft C, Wurst W, Haass C, Ellrichmann G, Gold R, Dittmar G, Hipp MS, Hartl FU, Tatzelt J, Winklhofer KF. A protein quality control pathway regulated by linear ubiquitination. Embo J 2019 May 2;38(9):e100730
Kelp A, Koeppen AH, Petrasch-Parwez E, Calaminus C, Bauer C, Portal E, Yu-Taeger L, Pichler B, Bauer P, Riess O, Nguyen HP. A novel transgenic rat model for SCA17 recapitulates neuropathological changes and supplies in vivo imaging biomarkers. J Neurosci 2013,33:9068-81
Yu-Taeger L, Petrasch-Parwez E, Osmand A, Redensek A, Metzger S, Clemens, L Park L, Howland D, Calaminus D, Gu X, Pichler B, Yang XW, Riess O, Nguyen HP. A novel BACHD transgenic rat ex-hibits characteristic neuropathological features of Huntington disease. J Neurosci 2012, 32:15426-38
Gerding WM, Schreiber S, Schulte-Middelmann T, de Castro Marques A, Atorf J, Akkad DA, Dekomien G, Kremers J, Dermietzel R, Gal A, Rülicke T, Ibrahim S, Epplen JT, Petrasch-Parwez E. Ccdc66 null mutation causes retinal degeneration and dysfunction. Hum Mol Genet 2011, 15:3620-31
Benali A, Trippe J, Weiler E, Mix A, Petrasch-Parwez E, Girzalsky W, Eysel UT, Erdmann R, Funke K. Theta-Burst Transcranial Magnetic Stimulation Alters Cortical Inhibition. J Neurosci 2011, 31:1193-203.
Seidel K, Schöls L, Nuber S, Petrasch-Parwez E, Gierga K, Wszolek Z, Dickson D, Gai WP, Bornemann A, Riess O, Rami A, Den Dunnen WF, Deller T, Rüb U, Krüger R. First appraisal of brain pathology owing to A30P mutant alpha-synuclein. Ann Neurol 2010, 67:684-9
Brüne M, Schöbel A, Karau R, Benali A, Faustmann PM, Juckel G, Petrasch-Parwez E. Von Economo neuron density in the anterior cingulate cortex is reduced in early onset schizophrenia. Acta Neuropathol 2010, 119:771-8
Nuber S, Petrasch-Parwez E, Winner B, Winkler J, von Hörsten S, Schmidt T, Boy J, Kuhn M, Nguyen HP, Teismann P, Schulz JB, Neumann M, Pichler BJ, Reischl G, Holzmann C, Schmitt I, Bornemann A, Kuhn W, Zimmermann F, Servadio A, Riess O. Neurodegeneration and motor dysfunction in a conditional model of Parkinson’s disease. J Neurosci 2008, 28:2471-84
Petrasch-Parwez E, Nguyen HP, Löbbecke-Schumacher M, Habbes HW, Wieczorek S, Riess O, Andres KH, Dermietzel R, Von Hörsten S. Cellular and subcellular localization of Huntingtin [corrected] aggregates in the brain of a rat transgenic for Huntington disease. J Comp Neurol 2007, 501:716-30
Rüb U, Brunt ER, Petrasch-Parwez E, Schöls L, Theegarten D, Auburger G, Seidel K, Schultz C, Gierga K, Paulson H, van Broeckhoven C, Deller T, de Vos RA. Degeneration of ingestion-related brainstem nuclei in spinocerebellar ataxia type 2, 3, 6 and 7. Neuropathol Appl Neurobiol 2006, 32:635-49
Petrasch-Parwez E, Saft C, Schlichting A, Andrich J, Napirei M, Arning L, Wieczorek S, Dermietzel R, Epplen JT. Is the retina affected in Huntington disease? Acta Neuropathol. 2005, 110, 523-5
Schmitz D, Schuchmann S, Fisahn A, Draguhn A, Buhl EH, Petrasch-Parwez E, Dermietzel R, Heinemann U, Traub RD. Axo-axonal coupling. a novel mechanism for ultrafast neuronal communication. Neuron 2001, 31:831-40


